Obstruction urétérale : nouvelle perspective avec la dérivation pyélo-vésicale extra-urétérale

Dr Stéphane Bureau, dip ECVS
Spécialiste en Chirurgie

Dr Yannick Bongrand, dip ACVIM-IM
Spécialiste Américain de Médecine Interne

Dr Pierre Maitre, dip ECVS
Spécialiste en Chirurgie
La morbidité et la mortalité associées à une obstruction urétérale justifient la mise en œuvre d’un traitement précoce et agressif afin de rétablir la perméabilité des voies urinaires et limiter des dommages permanents de la fonction rénale. En effet, une étude portant sur des chiens sains a montré une diminution définitive du débit de filtration glomérulaire de 35% après 7 jours d’obstruction et de 54% après 14 jours d’obstruction.1 Une issue moins favorable est donc attendue chez des individus ayant une hyperazotémie pré-rénale et/ou une maladie rénale chronique au moment de leur présentation. La mise en place d’un traitement médical et chirurgical est donc nécessaire. La dérivation pyélo-vésicale extra-urétérale (DPVE), également connue sous le nom de Subcutaneous Ureteral Bypass (SUBTM system, Norfolk Vet Product) est un système nouveau de dérivation urinaire permettant de court-circuiter l’uretère.
Ce document a pour objectif de rappeler brièvement les différentes options thérapeutiques (médicale, chirurgicale conventionnelle et stent pyélo-vésical) envisageables lors d’obstruction urétérale et de présenter de façon plus détaillée la technique de DPVE.
- Traitement médical
Le traitement médical a pour objectif de forcer la diurèse et repose sur l’utilisation d’une fluidothérapie agressive, de diurétique osmotique (perfusion continue de mannitol sur 24 heures), de spasmolytiques (amytriptyline et/ou α1-antagoniste) et d’une antibiothérapie large spectre (jusqu’à 30% d’infections urinaires concomitantes2). Malgré un faible taux de succès, inférieur à 10%2, le traitement médical devrait toujours être initié avant une prise en charge chirurgicale sauf en cas de contre-indication majeure (insuffisance cardiaque congestive notamment).
- Traitement chirurgical
Le traitement chirurgical conventionnel par urétérotomie, résection-anastomose ou urétéronéocystostomie est donc indiqué. Toutefois, la taille des uretères chez le chat (0,4 mm de diamètre intraluminal3), la présence fréquente de multiples calculs urétéraux (en moyenne 4 calculs par uretères), de calculs pyéliques concomitants (62 à 85% des cas2,3) sont à l’origine d’une morbidité et mortalité importantes. Une mortalité péri-opératoire de 18 à 21% est rapportée.2,4 Des complications sont notées dans 30 à 50 % des cas, avec notamment 6 à 15 % d’uroabdomen secondaires à des fuites sur le site chirurgical et nécessitant des reprises chirurgicales dans 13 % des cas et des récidives d’obstruction dans près de 40 % des cas, avec de nombreux cas de sténoses urétérales.2,4
- Stent pyélo-vésical
L’utilisation de stents pyélo-vésicaux a été récemment décrite en chirurgie vétérinaire. Il s’agit d’un système intra-urétéral laissé à demeure à l’origine d’une dilatation passive de l’uretère. La mise en place d’un stent est délicate et nécessite un matériel spécifique (fluoroscopie ou endoscopie) et une technicité adaptée. Malgré une mortalité péri-opératoire de 8%, relativement faible comparé aux techniques chirurgicales conventionnelles3, de nombreuses complications sont observées et incluent de la dysurie répondant à l’utilisation de prédisone et/ou prazozin (20-38%), des infection du tractus urinaire (8-30%), des récidives d’obstructions majoritairement associées à la présence de sténose (19-25%), une hématurie chronique (18%) et une migration du stent (6-8%)3,5-6. Un changement du stent s’avère nécessaire dans près de 27% des cas 3,5 ans après sa mise en place.3
. Dérivation pyélo-vésicale extra-urétérale
- Principe
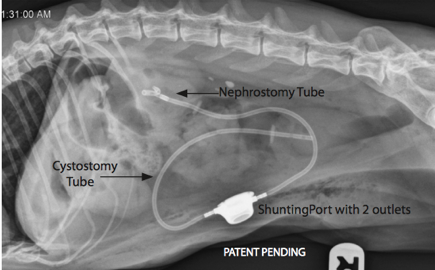
Contrairement aux techniques chirurgicales précédemment décrites, la DPVE s’affranchie de toute intervention au niveau de l’uretère, qui est complètement court-circuité, et donc des difficultés techniques liées à sa taille. La mise en place de ce dispositif est indiquée chez le chat et le chien en cas d’obstruction urétérale ou, moins communément, en cas de rupture urétérale d’origine traumatique. Elle est donc particulièrement indiquée en cas de sténose urétérale, qui représente jusqu’à 20% des cas d’obstruction ou lors de complications ou d’intolérance aux techniques précédentes. Une dilatation pyélique supérieure ou égale à 5 mm est une condition nécessaire préalable à la pose d’une DPVE. Le dispositif comprend une sonde de néphrostomie et une sonde de cystotomie reliée entre elles via une chambre de dérivation sous-cutanée. La mise en place d’une DPVE nécessite,un matériel spécifique et, une technicité adaptée.7
- Descriptif opératoire
Une laparotomie médiane xipho-pubienne est réalisée. Une sonde de néphrostomie est mise en place. Pour cela, un cathéter de 18 G est inséré au travers du rein, du pôle caudal jusqu’à la cavité pyélique sous contrôle fluoroscopique ou échographique. Un guide métallique de 0,0018’’ est ensuite introduit au travers du cathéter. Une sonde de néphrostomie de 6,5 Fr possédant une extrémité en ‘‘queue de cochon’’ est insérée sur le guide qui est retiré après que la partie proximale de la sonde se soit correctement enroulée dans la cavité pyélique. La sonde de néphrostomie est sécurisée au rein par l’application de colle chirurgicale sur la capsule rénale, au niveau du site d’entrée de la sonde. L’extrémité distale de la tubulure est ensuite tunnélisée en région sous-cutanée. La sonde de cystotomie est ensuite mise en place. Pour cela, une suture en bourse est placée à l’apex de la vessie et une sonde de cystostomie de 7 Fr montée sur mandrin est insérée au centre de cette suture. Une fois l’extrémité de la sonde dans la lumière vésicale, la sonde est sécurisée à la paroi vésicale par la mise en place de 4 points simples et par l’application de colle chirurgicale. La tubulure de la sonde de cystostomie, est ensuite tunnélisée de la même façon en région sous-cutanée. Les tubulures des deux sondes sont alors connectées entre elles par une chambre de dérivation sous-cutané, elle-même fixée en sous-cutané. Le dispositif est flushé sous contrôle fluoroscopique ou échographique via l’injection de soluté salin au travers de la chambre d’injection afin de vérifier l’étanchéité et la perméabilité du dispositif. L’ouverture abdominale est ensuite fermée plan par plan.
- Gestion post-opératoire
Une surveillance post-opératoire minimale de 48-72 heures est recommandée. La créatinine et les électrolytes sont réévalués quotidiennement. La fluidothérapie est ajustée en fonction du statut hydrique et électrolytique de l’animal. Une analgésie est requise ainsi qu’une antibiothérapie. L’uroculture réalisée à partir de prélèvements per-opératoires permet d’ajuster l’antibiothérapie, instaurée de façon probabiliste avant l’intervention.
- Complications
L’usage de ces dérivations est relativement récent en médecine vétérinaire. Nous manquons par conséquent d’études cliniques rétrospectives à moyen et long terme. A l’heure actuelle de nos connaissance, les complications post-opératoires semblent relativement rares et incluent des fuites sur le site de néphrostomie ou cystotomie (5%), l’occlusion du dispositif par un caillot sanguin ou par du matériel purulent résolue par injection de tissu plaminogen activator ou de solution saline stérile (5%).7 Une mortalité péri-opératoire de 5,6% est observée, le plus souvent secondaire à une insuffisance cardiaque congestive. A court terme, des complications mineures sont observées telles que de la dysurie (< 2%) et des séroma (1%). Des complications à long terme sont observées avec au premier rang des infections du tractus urinaire, traitées par une antibiothérapie ajustée (15%), des occlusions du dispositifs par des lithiases (7%), de la dysurie (2%) et des séromes (1%).7,6
- Suivi
Une réévaluation initiale est réalisée 1 à 2 semaines après l’intervention, puis à 1 mois et tous les 3 mois. Un bilan sanguin complet, une analyse urinaire, une culture, un RPCU, une mesure de pression artérielle systémique, une radiographie et/ou échographie abdominale sont idéalement réalisées. En cas d’hyperazotémie persistante (40 à 50% des cas), la mise en place d’une alimentation rénale, l’utilisation d’inhibiteur d’enzyme de conversion de l’angiotensine et de chélateur du phosphore, doivent être envisagés et ajustés en fonction du stade de la maladie rénale selon la classification IRIS. Afin de contrôler la perméabilité et de prévenir toute obstruction du dispositif par des lithiases, il est recommandé de flusher stérilement le dispositif tous les 3 à 6 mois sous contrôle fluoroscopique ou échographique.7 Un prélèvement d’urine est par la même occasion directement réalisé depuis la chambre de dérivation pour une mise en culture. Le recueil d’urine par cystocentèse est en effet contre-indiqué après mise en place du dispositif par risque d’endommagement de la sonde de cystotomie.
Conclusion :
L’utilisation d’une DPVE apparaît comme une option très intéressante pour la prise en charge chirurgicale des obstructions urétérales car elle semble diminuer de manière significative la morbidité et mortalité associées aux techniques ultérieurement décrites, et ceci notamment lors de sténose urétérale. Elle permet en effet de rétablir immédiatement la perméabilité des voies urinaires et de rétablir une fonction rénale adéquate et également de prévenir les risque de récidive d’obstruction urétérale dans près de 93% des cas. Par ailleurs, le dispositif semble bien toléré par les animaux et ceci-même après plusieurs années. Les complications à court et moyen terme sont rares et relativement mineures. Un contrôle régulier de la perméabilité du dispositif est toutefois recommandé afin de vérifier son bon fonctionnement. Même si cette technique est relativement récente et manque encore un peu de recul, de nombreux praticiens la considèrent aujourd’hui comme une technique de choix lors d’obstruction urétérale.
Références :
- Wilson DR. Renal function during and following obstruction. Annu Rev Med 1977; 28:329-339.
- Kyles AE, Hardie EM, Wooden, BG et al. Management and outcome of cats with ureteral calculi: 153 cases (1984–2002). J Am Vet Assoc 2005; 226: 937-934
- Berent AC, Weisse CW, Todd K et al. Technical and clinical outcomes of ureteral stenting in cats with benign ureteral obstruction: 69 cases (2006–2010). J Am Vet Assoc 2014;244: 559-576
- Roberts SF, Aronson LR, Brown DC. Postoperative mortality in cats after ureterolithotomy. Vet Surg 2011; 40: 483-443.
- Manassero M, Decambrom A, Viateau V et al. Indwelling double pigtail ureteral stent combined or not with surgery for feline ureterolithiasis : complications and outcome in 15 cases. J Feline Med Surg 2014; 16: 623-630
- Steinhaus J, Berent AC, Weisse C et al. Clinical presentation and outcome of cats with circumcaval ureters associated with a ureteral obstruction. J Vet Intern Med 2014.
- Berent AC and Weisse CW. The SUB : A subcutaneous Ureteral Bypass System : A surgical Guide. Norfolk Vet Products.