Mastocytomes de stade 4 traités par thérapie ciblée à base de masitinib : à propos de 4 cas

Dr Didier Lanore
Exercice exclusif de la cancérologie, ex-chargé de consultation de cancérologie de l’ENVT
–
Le mastocytome est la tumeur cutanée la plus fréquente dans l’espèce canine. Son comportement tumoral est variable avec un pouvoir métastatique important pour les tumeurs de haut grade ou d’indice Ki67 élevé ; les noeuds lymphatiques de drainage, la rate, le foie et la moelle osseuse étant les sites de dissémination. La présence d’une métastase systémique entraîne la classification clinique en stade 4, associé au pronostic le plus péjoratif. La survie spontanée après exérèse chirurgicale de ces mastocytomes cutanés de stade 4 est très courte, 1 à 3 mois maximum pour les atteintes spléniques ou hépatiques et d’1 mois environ pour les infiltrations médullaires. Nous décrivons l’évolution de 4 mastocytomes cutanés canins de stade 4 traités par thérapie ciblée à base de masitinib.
• Cas clinique n°1
Un Golden Retriever mâle de 13 ans est présenté à la consultation pour le traitement adjuvant d’un mastocytome de grade II et d’indice Ki67 supérieur à 10%, retiré sur la cuisse gauche. Une adénomégalie inguinale (9 cm) avec oedème et hémorragie sous-cutanée et lombo-aortique gauche (1.5 x 3 cm) sont observées ainsi qu’une lésion splénique hypoéchogène lors de la réalisation du bilan d’extension. Un stade clinique 4 sera déterminé par les examens cytologiques qui confirment des métastases au sein de la rate et des 2 noeuds lymphatiques hypertrophiés. La survie attendue est donc de 1 à 3 mois maximum. Un traitement palliatif à base de masitinib (12.5 mg/kg/j) est proposé et accepté par les propriétaires. Six jours après le début du traitement, l’animal est revu pour un probable épisode de lyse tumorale qui rentre dans l’ordre rapidement grâce à un arrêt temporaire du masitinib et un traitement symptomatique (sucralfate, ranitidine et oméprazole). Le masitinib est alors repris à 6 mg/kg/j avec un traitement médical préventif en parallèle (cimétidine, dexchlorpheniramine et prednisolone). Le chien est revu une semaine plus tard, les lésions ont nettement régressé (30% environ). Le traitement est poursuivi jusqu’à un échappement, 88 jours après la prescription initiale. Celui-ci se manifeste par un oedème marqué de la lésion et du membre et une ulcération cutanée étendue. L’animal est euthanasié à la demande des propriétaires.
• Cas clinique n°2
Un Golden Retriever de 9 ans est présenté à la consultation d’urgence suite à l’apparition brutale d’une masse inguinale, associée à un oedème. Un mastocytome de grade II et Ki-67 >10% sur le même site, a été traité (chirurgie + chimiothérapie), un an auparavant. La cytoponction échoguidée de la lésion inguinale confirme la métastase ganglionnaire du mastocytome (photo n° 1).
Photo n° 1 :
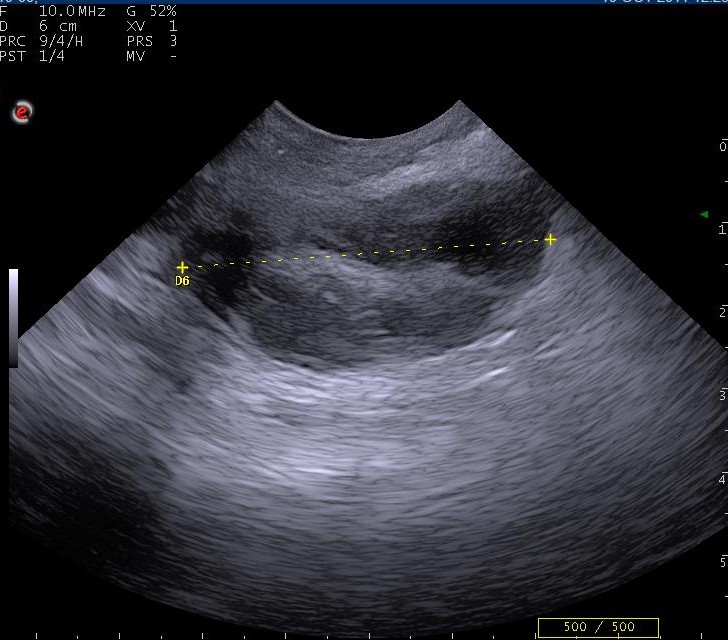
Photo n° 1 : Aspect échographique de la métastase ganglionnaire (cas n°2). Noter l’adénomégalie (4.4 cm de longueur), l’aspect hypoéchogène et hétérogène du noeud lymphatique (Crédit Dr Mathieu FAUCHER).
Le myélogramme réalisé dans le cadre du bilan d’extension complet montre une infiltration (6%) permettant de classer d’emblée la tumeur en stade clinique 4. Un traitement à base de masitinib (12.5 mg /kg/j) et d’antihistaminique (anti-H1 et H2) est mis en place. Une bonne tolérance clinique et biologique, ainsi qu’une réponse clinique avec diminution du volume de la tumeur de 75% environ seront objectivées au cours du suivi. Pour des raisons financières, la dose est diminuée à 9 mg/kg/j, sans répercussion sur les bilans biologiques. En revanche, un oedème important se développe en région inguinale. De la prednisolone (1mg/kg/j) et du dexchlorpheniramine (12 mg/j) sont administrés en traitement symptomatique, et une chimiothérapie à base de vinblastine (2 mg/m2) est ajoutée en complément de la thérapie ciblée. L’oedème disparait, mais la métastase ganglionnaire persiste conduisant à une décision d’exérèse chirurgicale du ganglion. Le chien décède malheureusement dans la nuit suivante sans cause identifiée. La survie depuis la mise en place du Masivet ® aura été de 99 jours.
• Cas clinique n°3
Une chienne caniche toy de 16 ans est présentée à la consultation pour la prise en charge d’un mastocytome cutané situé sur la face latérale du tibia gauche, diagnostiqué par cytologie. En raison de sa taille (2,5 cm) et de sa localisation, une chirurgie en marges saines même avec lambeau de reconstruction est impossible. L’échographie abdominale réalisée dans le cadre du bilan d’extension, révèle un parenchyme hépatique très anormal (cf. photo n°2), siège d’une métastase confirmée par l’examen cytologique (photo n°3). Le myélogramme ne montre pas d’infiltration.
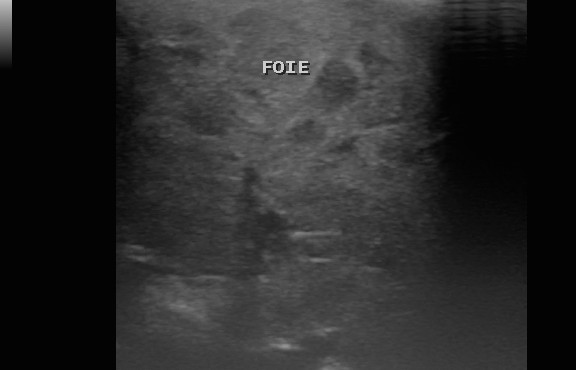
Photo n° 2 : Aspect échographique du parenchyme hépatique infiltré par des mastocytes tumoraux (cas n°3). Celui-ci est hétérogène avec présence de nombreux nodules hypoéchogènes (Crédit Dr Marc DOUCET).
Photo n° 3 :
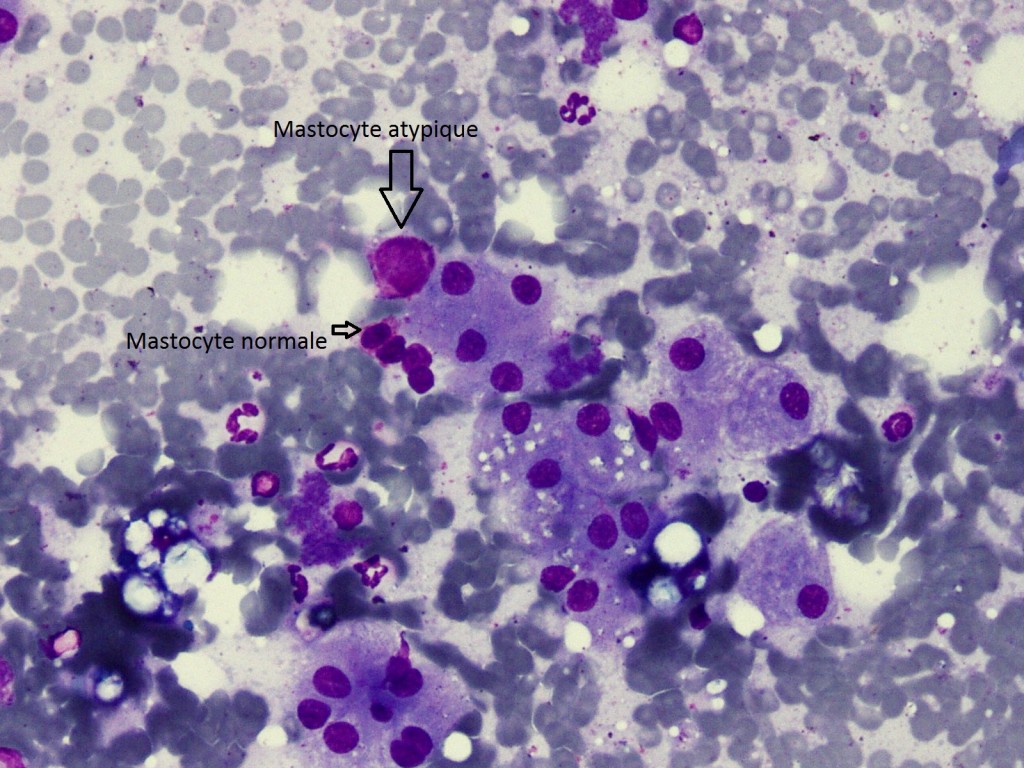
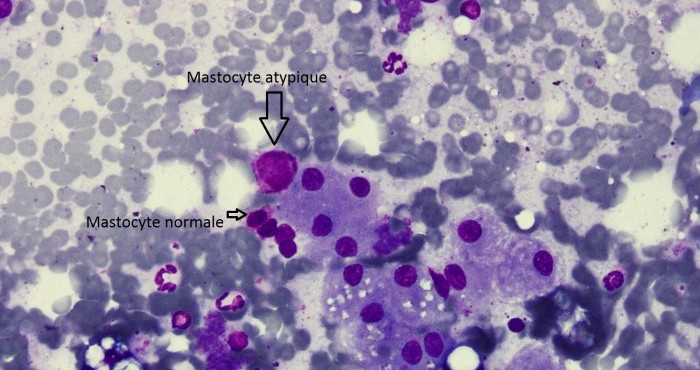
Présence de mastocytes atypiques au sein des hépatocytes (cas n°3) (Crédit CVet – Dr Delphine RIVIERE).
L’atteinte hépatique classe la tumeur en stade 4. Compte-tenu de l’irrésécabilité de la lésion et du bilan d’extension systémique positif, le pronostic est sombre. Les bilans biologiques ne montrant pas de contreindications, un traitement palliatif à base de prednisolone (1 mg/kg/j) et de masitinib (9 mg/kg/j) est décidé. Lors du premier contrôle à 15 jours, la lésion a nettement diminué de taille et présente une zone nécrotique centrale. Le contrôle sanguin montre une augmentation marquée des ALT (629 UI/l, plus de six fois la limite des valeurs usuelles) ; un traitement adjuvant hépato-protecteur (Zentonil®) est ajouté à la prescription. A 1 mois, la lésion a réduit de 90% en diamètre et le ganglion poplité n’est plus palpable. Les transaminases se sont stabilisées (699 UI/l) et la chienne ne présente aucun signe clinique particulier. A 2 mois, la tumeur est parfaitement stable mais une anémie modérée peu régénérative s’installe et les transaminases ont augmenté à 871 UI/L. Une pause thérapeutique du Masivet® est décidée. Les propriétaires abandonnent le traitement et ne se présenteront que 3 mois après la visite initiale. La tumeur a alors regrossi (1,5 cm) et le ganglion est à nouveau palpable. Les paramètres hépatiques sont toujours élevés et les propriétaires optent pour une chimiothérapie palliative, ne souhaitant pas prendre le risque d’une hépatotoxicité aggravée. 3 séances de vinblastine sont réalisées, sans réponse clinique et avec apparition d’une neutropénie de grade 3. Les propriétaires décident d’arrêter le traitement et la chienne sera euthanasiée 159 jours après la mise en place du masitinib.
• Cas clinique n°4
Un bouledogue mâle non castré de 10 ans est présenté pour une lésion scrotale présente depuis 3 mois. La masse est volumineuse, douloureuse et ulcéro-nécrotique. Les noeuds lymphatiques inguinaux superficiels sont modérément hypertrophiés. La race, la localisation et l’aspect sont en faveur d’un mastocytome. Une cytoponction de la masse confirme cette hypothèse. Un bilan d’extension complet est alors réalisé, comprenant une cytoponction des noeuds lymphatiques inguinaux superficiels, une échographie abdominale qui révèle une adénomégalie iliaque médiale et une splénomégalie avec un parenchyme hétérogène, des cytoponctions de la rate et du foie et un myélogramme. Les examens cytologiques confirment une métastase au niveau de tous les noeuds lymphatiques ponctionnés, de la rate, du foie et de la moelle osseuse. Les propriétaires acceptent pour raisons financières la proposition de traitement suivante : castration avec scrotectomie pour soulager à court terme l’animal, associée à un traitement palliatif par du masitinib. L’intervention se déroule sans problème et la cicatrisation est obtenue rapidement. Le jour du retrait des points et de la mise en place du masitinib (12.5 mg/kg/j associé à la prednisolone 1 mg/kg/j), les 2 noeuds lymphatiques inguinaux superficiels sont indurés et de diamètre
supérieur à 4 cm chacun. Au cours du mois de traitement suivant, la tolérance clinique et biologique (NF, créatinine, albumine, ALT, ALKP) est excellente. Les ganglions inguinaux ont disparu. Une échographie de contrôle montre une régression des noeuds lymphatiques iliaques médiaux et une nette amélioration de la splénomégalie et de l’hétérogénéité du parenchyme (photos n° 4 et 5). L’infiltration mastocytaire n’est plus visible sur les nouveaux examens cytologiques réalisés sur la rate, le foie et la moelle. La rémission clinique complète est donc confirmée. Le chien est revu tous les mois avec réalisation d’un bilan sanguin de contrôle et un examen clinique. Lors de la dernière visite à 205 jours après le début du masitinib, aucune
récidive n’a été détectée cliniquement et tous les contrôles sanguins sont dans l’intervalle des valeurs usuelles.
Photos n° 4 et 5 : Aspect échographique de la rate avant et après traitement par le masitinib (Crédit Dr Anaïs COMBES)
Tableau n° I : Récapitulatif des informations cliniques, histologiques et thérapeutiques des 4 cas de
mastocytomes cutanés de stade 4, traités par masitinib.
• Discussion
Faire un bilan d’extension complet
Les mastocytomes de stade 4 correspondent à une infiltration par des cellules tumorales de la rate, du foie et/ou de la moelle osseuse. Une telle dissémination systémique est exceptionnelle en dehors d’une atteinte ganglionnaire. Nos 4 cas présentent, tous, une métastase ganglionnaire avérée.
En conséquence et selon le consensus du GEO, lors d’atteinte ganglionnaire confirmée, des cytoponctions de la rate, du foie et de la moelle osseuse sont impératives.
Survie améliorée grâce au masitinib
La survie des mastocytomes de stade 4, après exérèse chirurgicale seule, est mal définie. Cependant, le consensus du GEO s’accorde sur une survie spontanée de 1 à 3 mois maximum lors d’atteinte splénique ou hépatique et d’1 mois environ lors d’atteinte médullaire. La survie de nos 4 cas traités par masitinib a été de 99 et au moins 205 jours (3,3 et 6.8 mois avec atteinte médullaire), et de 88 et 159 jours (2,9 et 5,3 mois avec, respectivement, une atteinte splénique et hépatique). Ces résultats, bien que non significatifs sur le plan statistique, sont supérieurs aux données de la littérature, orientant vers une possible indication du masitinib palliatif pour les mastocytomes cutanés canins de stade 4. Les recommandations du consensus du GEO sont également en faveur d’une telle utilisation palliative. La durée de réponse et de survie la plus longue lors de rémission complète décrite dans de nombreuses études sur l’utilisation palliative du masitinib est également retrouvée dans cette petite série.
Pas de résistance croisée entre la chimiothérapie et la thérapie ciblée
Le cas n°2 a montré une rémission partielle mais marquée (environ 75% de réduction du volume tumoral) avec le masitinib alors que le chien présentait une rechute après chimiothérapie à la vinblastine. Comme pour de nombreux traitements par thérapie ciblée en cancérologie humaine, il n’existe pas de résistance croisée entre la chimiothérapie (effet cytotoxique direct sur les cellules en cycle) et la thérapie ciblée par inhibiteur de tyrosine kinase (effet antiprolifératif). Le masitinib peut donc être utilisé avec succès après échec de la chimiothérapie (vinblastine ou lomustine) sur un même mastocytome.
Association possible chimiothérapie et thérapie ciblée
Ce cas illustre également la possibilité d’utiliser les 2 modes de traitement de manière concomitante : masitinib et vinblastine par exemple. Le protocole exact de cette association reste encore à définir (posologie de chaque molécule et rythmes d’administration). Une attention particulière devra être portée sur les toxicités induites de manière commune par les 2 thérapies : digestive (anorexie, diarrhée, vomissement) et hématologique (neutropénie, anémie) essentiellement. Une étude a ainsi démontré qu’il était impossible d’associer à pleines doses le tocéranibe et la vinblastine à cause des neutropénies induites (Robat et al. 2012). Bien que nous ayons utilisé des doses usuelles, aucune anomalie hématologique n’a été observée sur les NF de contrôle pour le chien traité dans cet article avec vinblastine et masitinib.
Réponse variable selon le site
Un dernier élément peut être souligné à partir de ces cas cliniques. La réponse à la thérapie ciblée, en l’occurrence du mastocytome aux inhibiteurs de c-kit, peut être différente selon le site (primitif ou secondaire). En effet, pour le cas n°3 nous avons observé une réponse complète pour la métastase ganglionnaire alors qu’une réponse partielle (diminution de volume de 90%) a été notée pour la tumeur primitive. Un statut mutationnel de c-kit identique entre la tumeur primitive et les sites métastatiques a pourtant été décrit dans 100% des cas analysés dans une étude récente (Marconato et al. 2014). La raison de cette différence de réponse entre le site primitif et secondaire pourrait donc s’expliquer soit par un mécanisme différent de l’action du masitinib sur c-kit, soit par une simple différence de volume ou encore par un éventuel statut mutationnel de c-kit différent entre la tumeur primitive et la métastase comme cela est décrit en humaine .
Gestion de l’hépatotoxicité du masitinib
L’hépatotoxicité, observée lors du suivi du cas n°3, est la modification biologique la plus fréquente dans notre expérience lors d’utilisation du masitinib (23% des cas, données non publiées). En médecine humaine (Shat et al. 2013), cette toxicité est bien documentée, lors d’utilisation des inhibiteurs de tyrosine kinase (ITK). Ses mécanismes sous-jacents sont cependant mal définis (principalement une altération de la fonction mitochondriale) et ne semblent pas avoir de relation avec l’effet sur la cible (c-kit par exemple). Les cas d’insuffisance hépatique ou de décès sont rares (cf. infra) et varient selon l’ITK employé mais imposent un suivi régulier des marqueurs hépatiques. La fréquence de ce suivi varie selon l’ITK mais doit être au moins mensuelle et dépend du résultat des tests à T0 (le suivi sera plus fréquent si ceux-ci sont déjà modifiés). Les tests couramment utilisés sont le dosage des ALT, des ALKP et de la bilirubine totale. La règle de Hy définit un risque d’hépatotoxicité sévère (10% de mortalité) lorsque les 3 conditions suivantes sont présentes : ALT > 3 fois la limite supérieure des valeurs usuelles (LSVU), la bilirubine > 2 fois la LSVU et les ALKP dans les valeurs usuelles. Cette règle n’est respectée dans la littérature que dans 0.4% des cas. Bien qu’un seuil exact ne soit pas établi avec certitude, il semble qu’un arrêt du traitement en deçà d’une valeur de 8 fois la LSVU pour les ALT permette la réversibilité des lésions hépatiques induites. Les signes cliniques, biologiques et même histologiques ne sont pas pathognomoniques de l’hépatotoxicité induite par les ITK. Cependant, la plupart (dont l’imatinib et le sunitinib) entraîne essentiellement une nécrose hépatocellulaire, voire une cirrhose. Dans tous les cas, il convient d’éliminer d’autres causes probables de modification des tests hépatiques : métastases ou infiltration hépatique par la tumeur et action des autres médicaments d’usage concomitant (prednisolone par exemple). Le recours à l’imagerie et à des biopsies peut donc s’imposer dans certains cas. En médecine vétérinaire, nous n’avons jamais observé et il n’est pas rapporté à notre connaissance de cas d’insuffisance hépatique ou de décès lié aux ITK. Un suivi identique est cependant nécessaire, il se base sur la mesure des mêmes marqueurs. Les règles définies pour le masitinib sont alors les suivantes : si les ALT sont > à 3 fois la LSVU et/ou la bilirubine > à 1,5 fois la LSVU, le traitement est interrompu jusqu’à un retour à la normale des paramètres hépatiques puis il est repris avec une réduction de dose à 9 mg/kg/j. Si les mêmes anomalies persistent, le traitement est interrompu définitivement. Il convient cependant d’adapter cette règle en fonction des résultats des tests à T0, des autres médicaments administrés (en particulier la corticothérapie ou la lomustine), des résultats des examen d’imagerie et ponctions/biopsies (présence d’une atteinte tumorale hépatique) et enfin du bénéfice apporté par l’ITK dans la gestion de la maladie cancéreuse.
–
Bibliographie
Jérôme ABADIE, Jean-Pierre ARMAND, Julia BUCHOLZ, Stéphane BUREAU, Marie-Christine CADIERGUES, Brigitte CLOETCHABRE,
Pauline DE FORNEL-THIBAUD, Frédérique DEGORCE-RUBIALES, Françoise DELISLE, Patrick DEVAUCHELLE, Eric
GUAGUERE, Antoine HIDALGO, Didier LANORE, Claude MULLER, Frédérique PONCE, Dan ROSENBERG, Cécile SOYER.
Consensus du GEO sur le mastocytome cutané canin
PratiqueVet, Supplément Novembre 2012, n°98.
Robat C, London C, Bunting L, McCartan L, Stingle N, Selting K, Kurzman I and Vail DM.
Safety evaluation of combination vinblastine and toceranib phosphate (Palladia®) in dogs: a phase I dose-finding study.
Veterinary and Comparative Oncology 2012; 10: 174-183.
Marconato, L., Zorzan, E., Giantin, M., Di Palma, S., Cancedda, S., & Dacasto, M. (2013).
Concordance of c-kit mutational status in matched primary and metastatic cutaneous canine mast cell tumors at
baseline.
Journal of Veterinary Internal Medicine 2014; 28: 547-53.
Shah, R. R., Morganroth, J., & Shah, D. R. (2013).
Hepatotoxicity of tyrosine kinase inhibitors: clinical and regulatory perspectives.
Drug Safety 2013; 36: 491-503.


