Cholecystoduodénostomie chez un furet : prise en charge médicale du patient, description de la technique utilisée
Cas clinique
-
Anamnèse et examen clinique
Un furet mâle non stérilisé de 3 ans ½ est référé à la clinique pour aggravation subit de son état avec apparition d’ictère. Il est suivi de façon intermittente par son vétérinaire traitant pour dysorexie et vomissements itératifs depuis 5 jours.
Il est totalement anorexique et abattu depuis ce matin. Il a fait quelques selles de très petite taille, moulées et de couleur normale.
L’animal pèse 1.5 kg (il a perdu 200g en 5 jours), il présente une déshydratation évaluée à 7%, sa température rectale est de 37°C. Le comportement exploratoire est limité et la démarche se fait à pas menus, le ventre très levretté. Ses yeux sont larmoyants et les paupières légèrement plissées. Il présente un poil piqué.
La palpation abdominale crâniale déclenche une douleur marquée manifestée par des trémulations musculaires et une contraction de la sangle abdominale.
-
Examens complémentaires
A) Bilans sanguins
Le sang est recueilli par ponction de la veine cave crâniale après anesthésie générale flash à l’Isoflurane®..
Les valeurs du bilan biochimique, à l’exception de la bilirubine, sont dans l’intervalle des valeurs normales. Le bilan hématologique montre une anémie modérée et une légère neutrophilie.
Une fluidothérapie intraveineuse (veine céphalique cathéter à bouchon (22G) est mise en place. Les besoins hydriques physiologiques sont évalués à 100 ml /kg/24h dans cette espèce soit 4ml / kg/h (1). La déshydratation étant d’environ 7%, le volume horaire de perfusion de cet animal est de (4ml X1.5kg) + 0.07X1.5×1000 / 24h = 10ml/h. L’utilisation d’un pousse seringue ou d’une pompe à perfusion est nécessaire pour des volumes si faibles.
B) Echographie
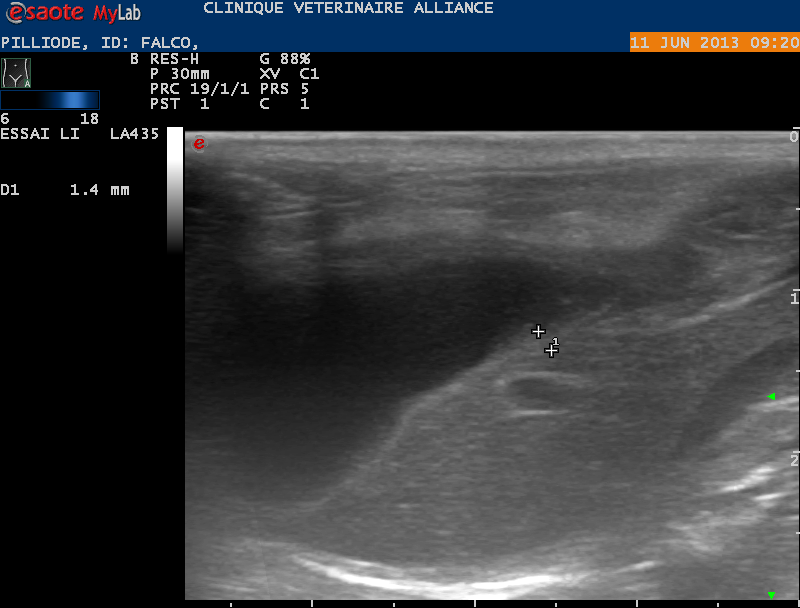
Réalisée au moyen d’une sonde linéaire de15, l’échographie révèle une réfringence accrue de la graisse en regard du foie. La vésicule biliaire est très dilatée, de forme normale et de contenu anisoéchogène mais peu échogène. Le pancréas semble plus échogène que la norme, ce qui peut laisser soupçonner une pancréatite. Les intestins grêles sont épaissis et ne présentent pas de péristaltisme mais la structure en trois feuillets est respectée. Les ganglions mésentériques sont hypertrophiés.
Malgré l’anorexie l’estomac n’est pas vide. La présence de gaz liés au retard de vidange gastrique ne permet pas de trancher sur l’existence ou non d’un corps étranger stomacal.
Le parenchyme hépatique, les surrénales, les reins sont d’aspect échographique normal.
-
Traitement
A) Prise en charge médicale
L’éventualité d’une pancréatite impose la mise en place d’une perfusion MLK (2,3). La posologie est de 10 ml /kg/h d’une solution saline 0.9% additionnée de : morphine (3.3 microg/kg/min), lidocaine (50 microg/kg/min), ketamine (10microg/kg/min) (3)
L’antibiothérapie est initiée par voie parentérale : amoxicilline-a. clavulanique 20mg/kg bid (Synulox®), métronidazol 20mg/kg bid (Flagyl ®) IV. L’utilisation conjointe de ces antibiotiques permet de couvrir les risques de développement de péritonite surinfectée par des germes digestifs (aérobies ou anaérobies. La ranitidine (Azantac®) est délivrée en IV à la dose de 4mg/kg trois fois par jour du fait de la prédisposition de cette espèce aux ulcères gastriques (4,5).
B)Le traitement chirurgical
Protocole anesthésique : dexmedétomidine 0.01 mg /kg (Dexdomitor ®), relai Isoflurane® induction au masque , puis mise en place d’une sonde trachéale de 2mm sans ballonnet.
L’animal est placé en décubitus dorsal, une laparotomie médiale crâniale est pratiquée de l’ombilic jusqu’au sternum.
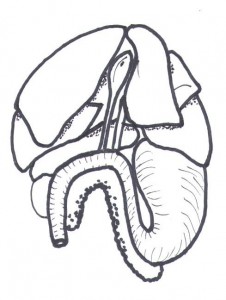
Figure 1 Anatomie simplifiée du foie lors de la laparotomie exploratrice. Les lobes carré et médian gauche ont été réclinés sur le côtés gauche(2).
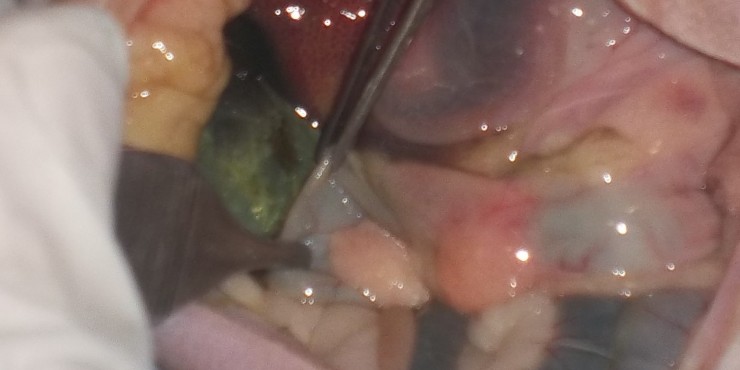
La présence de bile et de fibrine est notée dans la cavité abdominale crâniale au voisinage direct du foie. Le canal cholédoque est déchiré sur 2mm dans sa longueur en partie distale, proche de la papille duodénale majeure.
La vésicule biliaire, intègre, est disséquée de ses adhérences avec le foie et réclinée vers l’anse duodénale. Elle est incisée sur 5mm selon son grand axe sur sa face ventrale.
Le contenu est prélevé sur milieu SWAB de façon à réaliser une mise en culture en vue d’un antibiogramme.
Un écouvillon sec est frotté de façon énergique sur les parois de la vésicule biliaire pour la recherche d’Helicobacter par PCR.
Le contenu de la vésicule biliaire est gélatineux et très difficile à extraire, l’incision sur la paroi vésicale est prolongée de 5 mm.
Un curetage suivi d’un rinçage minutieux de la vésicule biliaire et de la cavité abdominale au moyen de NaCl 0.9% réchauffé est réalisé.
L’anse duodénale est tractée doucement en position crâniale.
Les deux extrémités de l’incision réalisée sur la paroi de la vésicule biliaire sont maintenues au contact de la séreuse du duodénum sur la face externe de l’anse duodénale (côté opposé à celui où se loge le pancréas) par deux points simples de fil monofilament résorbable Monocryl 6/0 ®. Les chefs en sont gardés longs afin de pouvoir maintenir une certaine traction sur les tissus afin de faciliter la suture.
( les photos des chirurgies ont été prises par reconstitution de l’opération sur cadavre).
L’abouchement doit se faire au niveau du duodénum en aval de la papille duodénale mineure afin de ne pas risquer de léser celle-ci.
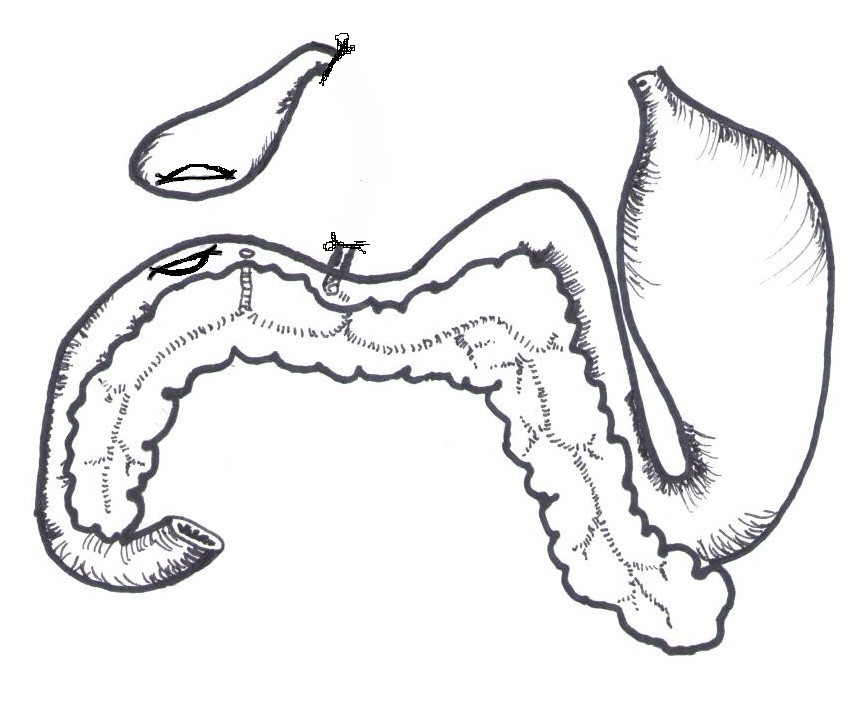
Figure 2 d’après (2,7) Anatomie simplifiée ligature et section de la partie lésée du cholédoque et abouchement des ostiums créés dans la vésicule biliaire et le duodénum.
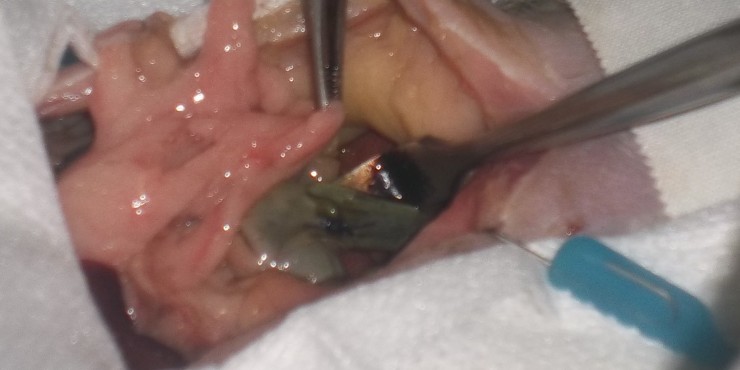
Une incision de 1cm de longueur est effectuée selon le grand axe du duodénum au travers des trois couches tissulaires intestinales.
L’ostium réalisé sur la vésicule biliaire et celui du duodénum sont abouchés par un surjet simple transfixant débutant sur la face profonde pour finir sur la face superficielle au moyen du même fil. Le fil de suture est alors noué au fil d’accroche déjà en place. La plaie est épiploïsée par enrobage de la vésicule biliaire par l’épiploon gastrique
La cavité abdominale est abondement rincée au NaCl 0.9% réchauffé, et les sutures des muscles abdominaux et cutanés sont celles, classiques, des laparotomies abdominale
C) Suites chirurgicales
Le traitement médical est poursuivi dans son intégralité pendant les 24 heures suivantes. La reprise alimentaire spontanée est rapide. L’appétence pour le Fortol ® permet à l’animal d’être réalimenté par voie orale 4 heures après la chirurgie.
La perfusion est retirée le lendemain, les paramètres physiologiques étant stables. L’animal émet des selles abondantes, molles et noirâtres mais non diarrhéiques. Les croquettes ramollies au Fortol® sont consommées dès le lendemain. Il est rendu à ses propriétaires deux jours après la chirurgie avec le traitement médical suivant :
amoxicilline-a. clavulanique(Synulox®) 20mg/kg bid, métronidazol 20mg/kg(Flagyl ®) IV bid ,cimétidine 5 mg/kg (Zintac®) tid, Dimeticone (Polysilane Upsa®).
D) Résultats des analyses
La recherche d’Helicobacter est négative, le métronidazole , extrêmement difficile a faire ingérer au furet ne sera maintenu que 10 jours
l’amoxicilline-a.clavulanique sera poursuivi 10 jours de plus car l’antibiogramme révèle un Escherichia coli sensible a cet antibiotique.
Discussion
- L’examen clinique
L’examen clinique du furet diffère de beaucoup de celui des autres carnivores domestiques car celui-ci exprime très mal la douleur et il est important de l’examiner en connaissant ces différences. Il est rare d’avoir une réaction agressive de défense d’autres deviennent intouchables en cas de douleur.
- Les causes de cholestase
Les causes d’obstructions biliaires extra hépatiques sont dans la plupart des cas chez les carnivores domestiques liées à des tumeurs ou des pancréatites (5). Les cholelithes sont rares dans ces espèces (5,6,8).
Des néoplasies ont été décrites : adénome ou adénocarcinome biliaires, cystadénome ou cystadénocarcinomes(5).
Les cas de mucocoeles de la vésicule biliaire sont très peu rapportés chez le furet.
II est souvent difficile de savoir si la pathologie est primitive ou secondaire à une inflammation de la papille duodénale majeure (5,8). L’hyperplasie la de papille et de la muqueuse de la vésicule biliaire a été rapportée dans cette espèce (7).
- Les examens complémentaires diagnostiques
Le profil biochimique de ce patient n’est pas modifié, ce qui n’est pas le cas dans la plupart des cas publiés.
La clearance urinaire de la bilirubine est très élevée et l’ictère est très rare dans cette espèce (7). La bilirubinurie est un des paramètres les plus fiable lors d’obstruction biliaire.
La lipasémie n’a pas été recherchée, son élévation semble plus signer une entérite inflammatoire qu’une pancréatite chez le furet (9).
L’hématocrite est naturellement très élevé dans cette espèce (46-61 %), il est à noter que l’anesthésie à l’isoflurane utilisée quasi systématiquement pour réaliser les ponctions veineuses est responsable d’une modification des valeurs de toute la lignée rouge dont il faut tenir compte (10).
- Traitement
L‘utilisation de la perfusion a débit constant de Morphine-Lidocaïne-Kétamine présente l’intérêt supplémentaire de calmer l’animal dans cette espèce qui a tendance à arracher extrêmement rapidement sa perfusion veineuse.
Le métronidazole est difficile à faire ingérer au furet. Les propriétaires doivent être prévenus des réactions violentes de l’animal lors de l’administration du médicament que ce soit sous forme liquide ou comprimé : tentative de vomissements violents, frottements virulents des commissures labiales.
Conclusion
Cette technique chirurgicale, très illustrée dans l’espèce féline, présente un taux de complications important. Le peu de cas de furets opérés ne permet pas d’établir des statistiques. La présence d’une pancréatite est péjorative dans l’évolution post opératoire pour les chiens et les chats. Or il semble difficile de diagnostiquer cette entité pathologique dans cette espèce compte tenu des particularités anatomiques (mal définies), biochimiques (peu spécifiques) et de l’absence d’un test propre à l’espèce(9).
A l’instar de la technique privilégiée à l’heure actuelle dans l’espèce féline la pose de stent à des fins de reperméabilisation du cholédoque a été décrite sur deux furets(11), mais ce n’était pas réalisable dans ce cas.
-
Risi E. Anémie, fluidothérapie et transfusion chez le furet. Proceedings Puy-du-Fou. 2014 : 47-51.
-
Graveron,E. Prise en charge nutritionnelle des pancréatites aiguës chez le chien et le chat. Thèse d’exercice, Ecole Nationale Vétérinaire de Toulouse – ENVT, 2009.
-
Muir WW , Wiese AJ, March PA. Effects of morphine, lidocaine, ketamine, and morphine-lidocaine-ketamine drug combination on minimum alveolar concentration in dogs anesthetized with isoflurane. Am J Vet Res. 2003 Sep;64(9):1155-60.
-
Queensberry KE, Carpenter JW. Ferrets, Rabbits and Rodents. Clinical Medicine and Surgery. 2nd Saunders. 2004:188-193.
5. Hall B A and Ketz-Riley C J, Cholestasis and cholelithiaisis in a domestic ferret( Mustela putorius furo). J VET Diagn Invest 2011 23: 836
-
Huynh M, Guillaumot P, Hernandez J, Ragetly G. Gall bladder rupture associated with cholecystitis in a domestic ferret (Mustela putorius). Journal of Small Animal 2014;55(9):479-82
Poddar S. Gross and microscopic anatomy of the biliary tract of the ferret. Acta Anat (Basel). 1977;97(2):121-126
8. Hauptman K, Jekl V,Knotek L. Extrahepatic biliary tract obstruction in two ferrets (Mustela putorius furo) Journal of Small Animal Practice2011; 52, 371–375
9. Mayer J. Interpreting the chemistry profile in ferrets, Conference 2008 Proceedings, p1851-1853
10. Pollock C, Emergency medicine of the ferret. Veterinary Clinics of North America: Exotic Animal. 2007 – Elsevier
-
Ronot P, Blaond L, Buttin R et coll. Choledochal tube stenting indomestic ferrets (mustela putorius furo)two cases. Icare Proceedings 2015.