Thrombocytopénie à médiation immune chez un chien caniche femelle stérilisée de 9 ans.

Ancien interne en médecine de l’ENVT, DU des thérapies d’épuration extra-rénales, médecine interne, uro-néphrologie
Avec la participation de Juliette Bouillon, ancienne assistante du Dr Yannick Bongrand
–
Introduction
La thrombocytopénie à médiation immune est une affection occasionnellement rencontrée chez le chien. Elle peut se traduire par des manifestations hémorragiques, qui imposent une prise en charge précoce et rigoureuse. En effet, tout délai peut avoir des conséquences dramatiques.
Commémoratifs
Vickie, caniche femelle stérilisée de 9 ans, est référée en consultation d’urgence pour la prise en charge d’une thrombocytopénie. Elle présente une forte dysorexie depuis 6 jours.
Une consultation chez le vétérinaire traitant 2 jours auparavant a permis d’observer une hématochézie et un méléna. Vickie présentait également des pétéchies et son temps de saignement gingival évalué par une méthode non standardisée était allongé. Un frottis à l’oreille n’avait permis de détecter aucun hémoparasite.
Examen clinique
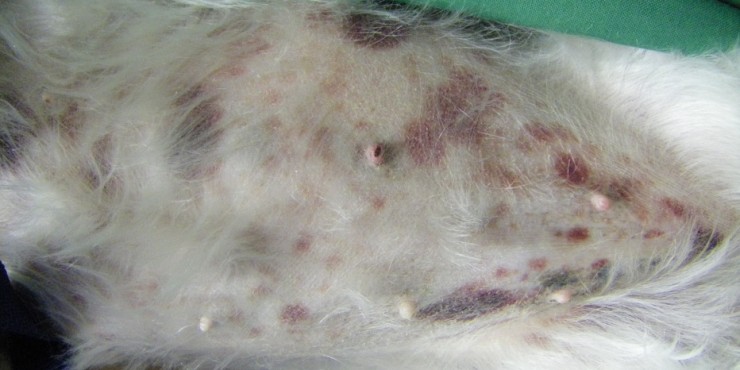
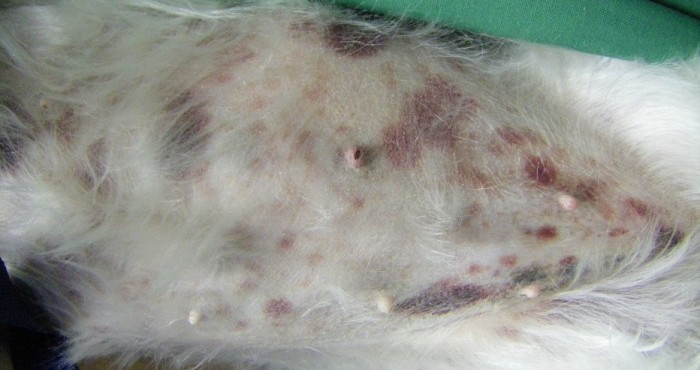
Vickie est abattue et normotherme (38.9°C). Son examen clinique révèle des muqueuses roses associées à de nombreuses pétéchies sur les muqueuses gingivales. L’examen de l’appareil cardiovasculaire met en évidence un souffle holosystolique apexien gauche de grade II/VI, la fréquence cardiaque est normale et le rythme régulier. Son examen respiratoire est sans anomalie. Une douleur diffuse modérée est constatée à la palpation abdominale. Des ecchymoses sont observées sur l’abdomen (Figure 1).
Examens complémentaires :
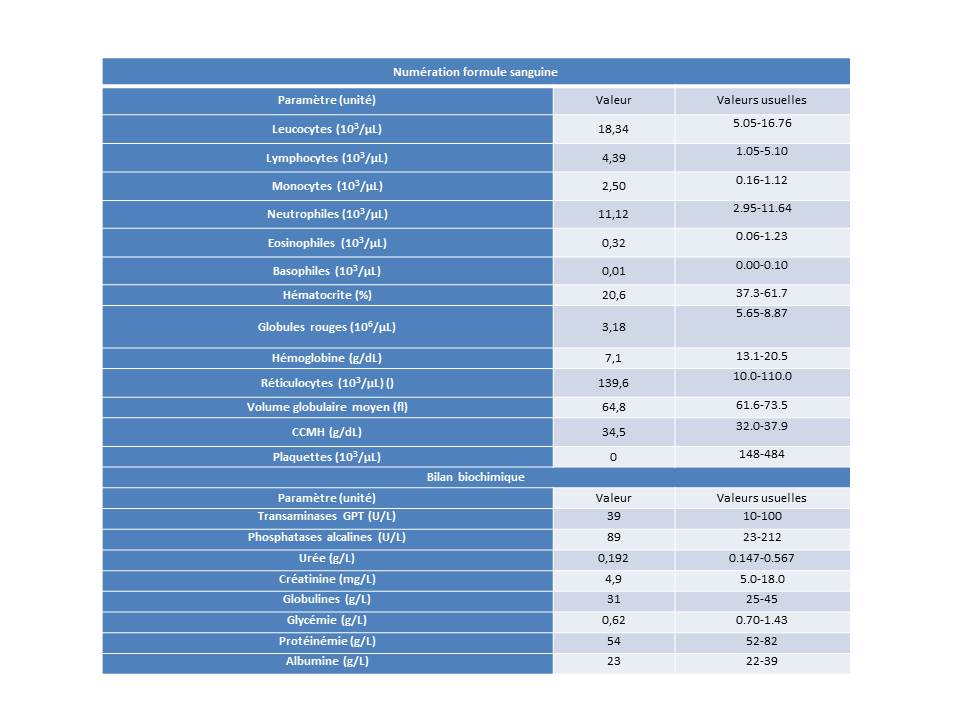
La numération formule indique une thrombopénie majeure (0 plaquettes/µL) et une anémie normocytaire normochrome régénérative (Figure 2). Une anisocytose et une polychromatophilie sont observées au frottis sanguin et aucun hémoparasite n’est identifié. Une leucocytose associée à une monocytose sont indiquées par l’automate. Toutefois, la monocytose est infirmée à la lecture du frottis sanguin ; les leucocytes comptés comme des leucocytes par l’automate correspondent à des formes immatures de neutrophiles. Le temps de Quick et le temps de céphaline activée sont identiques à ceux d’un patient sain servant de contrôle. Un examen biochimique révèle une albuminémie dans les valeurs usuelles basses et une hypoglycémie artéfactuelle liée à un stockage prolongé de l’échantillon avant analyse.
Vickie souffre d’un trouble de l’hémostase primaire causé par une thrombocytopénie : le diagnostic différentiel inclut les maladies infectieuses (ehrlichiose, anaplasmose, babésiose, leishmaniose, dirofilariose), une atteinte néoplasique, une coagulation intravasculaire disséminée (CIVD) ou une thrombocytopénie à médiation immune qui peut être primaire ou secondaire.
L’anémie régénérative, l’albumine basse, l’absence d’ictère et la présence de méléna sont en faveur d’une perte sanguine aiguë d’origine digestive.
Des radiographies thoraciques ne révèlent aucune anomalie. L’échographie abdominale est normale hormis la présence d’une plage hypoéchogène à bords irréguliers de 5mm de diamètre au niveau du pôle crânial de la rate et de myélolipomes. La lésion splénique n’a pas été ponctionnée en raison de la thrombocytopénie. Une adrénomégalie gauche est également visualisée.
Un test Elisa de dépistage rapide de la dirofilariose, l’ehrlichiose, la maladie de Lyme et l’anaplasmose est négatif (Snap test 4Dx, Idexx).
Hypothèse diagnostique
Une thrombocytopénie à médiation immune est fortement suspectée. Aucune affection sous-jacente n’a été identifiée, mais un foyer infectieux ou une néoplasie occultes ne peuvent cependant pas être définitivement exclus.
Traitement
Vickie reçoit un traitement de soutien digestif indiqué par la présence de saignements gastro-intestinaux. Des anti-sécrétoires sont administrés (pantoprazole et ranitidine) pendant 5 jours. Du sucralfate, métoclopramide et amoxicilline sont également administrés pendant 1 semaine.
L’immunosuppression est assurée par de la dexaméthasone 0.25 mg/kg sid IV, de la ciclosporine 6.25 mg/kg sid PO et une injection unique de vincristine 0.02 mg/kg IV.
De la doxycycline est administrée afin de couvrir toute atteinte infectieuse non détectée.
Le suivi de l’hématocrite et une estimation de la numération plaquettaire sont réalisés quotidiennement (graphique). La numération formule réalisée 5 jours après la mise en place du traitement confirme l’augmentation de la numération plaquettaire et la stabilisation de l’hématocrite.
Malgré la persistance d’un saignement digestif 5 jours après le début du traitement, par souhait du propriétaire, Vickie sort d’hospitalisation avec le traitement suivant: ciclosporine 6.25 mg/kg sid PO, prednisolone 1mg/kg bid PO, doxycycline 5mg/kg bid PO pour un total de 2 semaines, oméprazole 1 mg/kg sid PO 3 semaines et amoxicilline 10 mg/kg bid PO jusqu’à disparition des signes de saignement digestif.
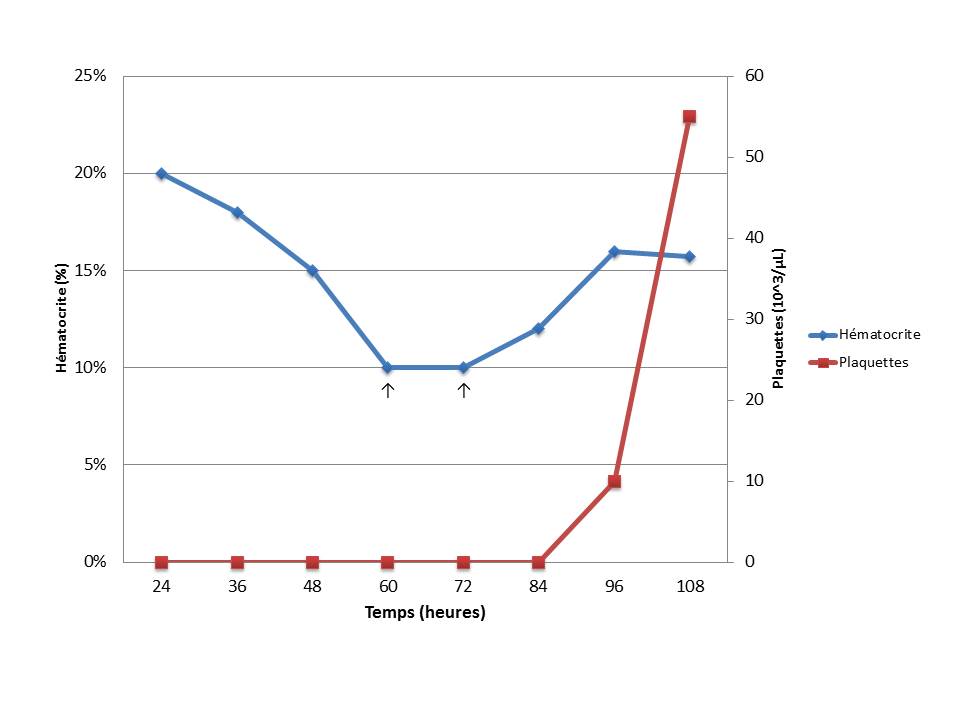
Figure 3. Suivi de l’hématocrite et de la numération plaquettaire au cours de l’hospitalisation de Vickie. Les flèches représentent chacune la réalisation d’une transfusion de sang frais.
Suivi
Le suivi est ensuite réalisé de façon moins régulière par rapport aux intervalles de recommandation. Vingt-huit jours après la sortie, la numération formule indique une numération plaquettaire normale à augmentée (546.000 plaquettes/µL), un hématocrite quasiment normal (34%), et une leucocytose neutrophilique. Vickie présente des signes d’hypercorticisme iatrogène (fatigue, polyurie, polydipsie, alopécie). La posologie de la prednisolone est diminuée à 1 mg/kg/jour et la ciclosporine est maintenue à la même dose.
Quinze semaines plus tard, la numération plaquettaire est toujours élevée (651000 plaquettes/µL) et les signes d’hypercorticisme ont rétrocédé. La posologie de la ciclosporine est diminuée de moitié (25mg sid PO soit 2.7 mg/kg) et la prednisolone est maintenue à la même dose. Une échographie abdominale de contrôle montre la disparition de la lésion hypoéchogène splénique mais une persistance des myélolipomes et de l’adrénomégalie gauche.
Discussion
Une thrombocytopénie est associée aux signes caractéristiques d’un trouble de l’hémostase primaire : pétéchies, ecchymoses, épistaxis et saignements digestifs. Ces manifestations sont susceptibles d’apparaître lorsque le nombre de plaquettes est inférieur à 30000-50000/µL de sang. Dans notre cas, le taux plaquettaire présenté par Vickie est très bas (0/µL) et explique la présence de pétéchies, d’ecchymoses et de méléna.
Lorsqu’une thrombocytopénie est identifiée par l’automate, il convient de la confirmer par la lecture d’un frottis sanguin. En effet, les agrégats plaquettaires ou la présence de macroplaquettes peuvent être responsables de thrombocytopénies artéfactuelles. Une anémie régénérative est causée par une perte sanguine significative ou par une hémolyse. Dans notre cas, l’absence d’ictère et de pigmenturie associée à l’évidence d’une perte sanguine nous ont permis d’écarter cette dernière possibilité.
En cas de thrombocytopénie seule, le diagnostic différentiel inclut les causes liées à un défaut de production, une séquestration, une consommation ou une destruction plaquettaire. Les affections responsables d’une thrombocytopénie regroupent les maladies infectieuses, les CIVD, les vasculites, les pertes sanguines, les néoplasies, et les thrombocytopénies à médiation immune primaire ou secondaire.
Chez Vickie, l’ehrlichiose, la dirofilariose, l’anaplasmose et la borréliose ont été testées négativement par un test Elisa. Dans une étude, ce test Elisa a révélé des performances excellentes comparées aux méthodes de référence et dans la population étudiée (Nord-est des Etats-Unis). Aucune recherche de leishmaniose n’a été réalisée. Un frottis sanguin n’a pas permis de mettre en évidence de Babesia. Toutefois, cette méthode est peu sensible et peu spécifique. Une recherche par PCR permettrait d’exclure une babésiose définitivement. Une antibiothérapie (doxycycline 5 mg/kg bid PO) a été instaurée pendant 2 semaines dans l’hypothèse d’une maladie infectieuse (notamment une rickettsiose) non identifiée.
Par ailleurs, le bilan d’extension d’imagerie est peu en faveur d’une atteinte néoplasique ou d’un foyer infectieux occulte. Les images échographiques de la rate peuvent être suggestives d’une hématopoïèse extra-médullaire, une hyperplasie nodulaire ou une néoplasie débutante. La glande surrénale gauche de taille augmentée peut être la conséquence d’une hyperplasie surrénalienne, une tumeur primitive sécrétante ou non, un lipome, un granulome ou une métastase.
L’hypothèse diagnostique est donc une thrombocytopénie à médiation immune idiopathique ou primaire.
Dans cette affection, des auto-anticorps sont produits contre les plaquettes, conduisant à leur opsonisation et leur phagocytose par les macrophages. Le comptage plaquettaire est souvent extrêmement bas.
Lors de thrombocytopénie à médiation immune, le myélogramme ne doit être considéré que si le nombre de plaquettes n’augmente pas après 5 à 7 jours d’une thérapie immunosuppressive. Le taux plaquettaire de Vickie a commencé à augmenter dès la fin du 4e jour après le début du traitement immunosupresseur. Cet examen n’a donc pas été réalisé dans son cas.
Une thrombocytopénie à médiation immune peut être primaire ou secondaire. Elle est considérée comme primaire ou idiopathique quand aucune cause sous jacente n’a été identifiée. Dans notre cas, à la lumière des examens complémentaires déjà réalisés, un processus primaire est envisagé. Cependant, plusieurs points méritent une attention particulière dans le suivi : les images échographiques anormales splénique et surrénalienne ainsi que l’absence d’exclusion de la leishmaniose.
Le traitement initial de choix est une corticothérapie à dose immunosuppressive. Un nombre de plaquettes suffisant est observé 7 jours en moyenne après l’initiation du traitement.Des molécules immunosuppressives adjuvantes peuvent être mises en place lors d’atteinte sévère, d’absence de réponse après 14 jours de corticothérapie ou lorsque les effets secondaires de la corticothérapie ne sont pas acceptables.
L’association de vincristine aux glucocorticoïdes est associée à une augmentation plus rapide de la numération plaquettaire (médiane de 4.9 jours contre 6.8 jours lors de corticothérapie seule) et à une durée d’hospitalisation plus brève des patients (médiane de 5.4 jours contre 7.3 jours lors de corticothérapie seule). Une accélération de la thrombopoïèse et une diminution de la phagocytose des plaquettes opsonisées pourraient expliquer cette action. Les effets secondaires rapportés lors d’utilisation de vincristine chez le chien (vomissements, diarrhée, phlébite, myélosuppression) sont fréquemment observés aux doses recommandées.
L’immunoglobuline recombinante humaine associée à des glucocorticoïdes conduit à des résultats similaires en terme de vitesse de réponse à ceux de l’association vincristine et glucocorticoïdes. Toutefois, la vincristine étant moins onéreuse, plus disponible et plus simple d’utilisation, son usage est favorisé en première intention. Il n’en est pas moins que la vincristine est un anticancéreux qui est donc soumis à des conditions d’utilisation contraignantes.
Finalement, le traitement est peut être complété par l’ajout d’un autre immunosuppresseur comme la ciclosporine. Cette molécule a essentiellement une activité immunosuppressive via l’inhibition de l’activité lymphocytaire. Les effets secondaires sont des troubles digestifs, une hyperplasie gingivale, une dermatite.
Le suivi doit être initialement effectué tous les 8 à 15 jours, puis toutes les 4 semaines environ. Le protocole d’immunosuppression est allégé progressivement afin d’éviter d’éventuelles rechutes. Leur fréquence est élevée (41%) et elles constituent un facteur pronostique péjoratif de la maladie.
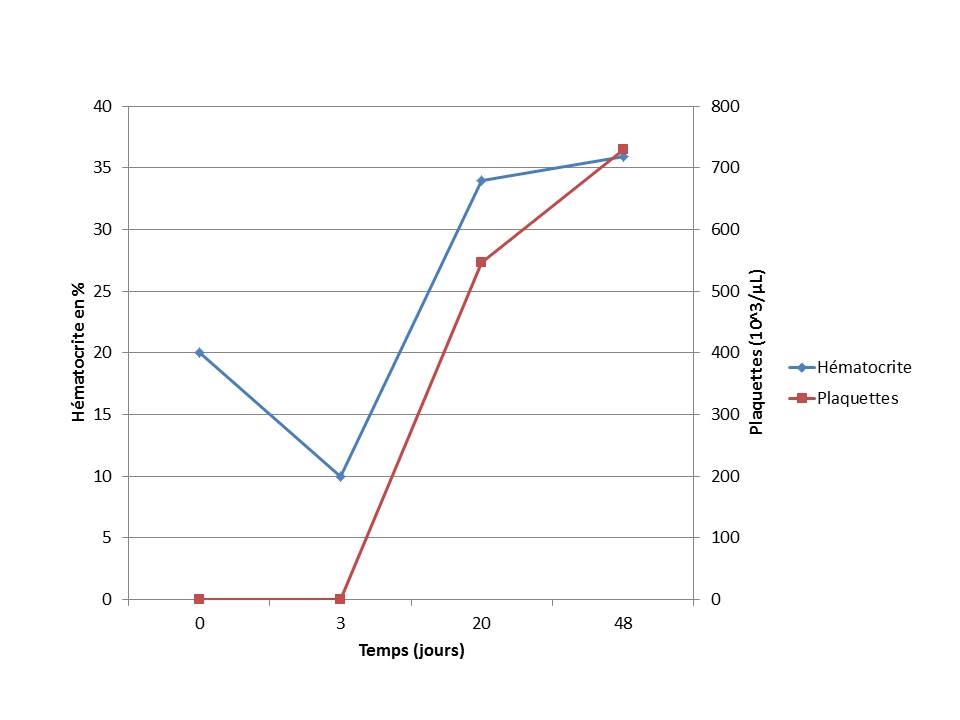
Figure 4. Suivi des paramètres hématologiques au cours des 48 jours suivant l’hospitalisation de Vickie.
Conclusion
La thrombocytopénie à médiation immune est une maladie rencontrée occasionnellement, dont le diagnostic et la prise en charge thérapeutique doivent être réalisés de manière précoce. Le taux de réponse au traitement est élevé (79%) mais le taux de mortalité reste important (30%). Le pronostic de cette affection doit toujours rester réservé : son évolution n’est pas prévisible et l’état général de l’animal au moment du diagnostic ne présage ni de l’évolution de la maladie, ni de la probabilité de rémission.